
撤回 MAA 的決定是根據歐洲藥品管理局 (EMA) 人用藥品委員會的反饋做出的。阿斯利康和第一三共將繼續努力 將 datopotamab deruxtecan 帶給歐盟的肺癌患者,使他們能夠從中受益,並致力於通過我們強大的臨牀開發計劃釋放這種藥物在肺癌治療中的潛力,該計劃包括在不同肺癌環境中進行的七項關鍵試驗。
阿斯利康和第一三共基於TROPION-Breast01三期臨牀試驗在歐盟提出的 datopotamab deruxtecan 用於治療激素受體 (HR) 陽性、HER2 陰性轉移性乳腺癌的申請仍在審查中。
Datopotamab deruxtecan 是一種專門設計的 TROP2 導向 DXd 抗體藥物偶聯物 (ADC),由第一三共發現,並由阿斯利康和第一三共聯合開發。
阿斯利康在2024 WCLC公布TROPION-Lung01臨牀研究,同時也在ASCO雜誌上發表文章「Datopotamab Deruxtecan Versus Docetaxel for Previously Treated Advanced or Metastatic Non–Small Cell Lung Cancer: The Randomized, Open-Label Phase III TROPION-Lung01 Study」,公開其臨牀數據。
該臨牀研究共有299名患者和305名患者分別被隨機分配接受Dato-DXd或多西他賽治療。Dato-DXd組的中位無進展生存期(PFS)為4.4個月(95% CI, 4.2至5.6),多西他賽組為3.7個月(95% CI, 2.9至4.2)(危險比 [HR], 0.75 [95% CI, 0.62至0.91];P = 0.004)。中位總生存期(OS)分別為12.9個月(95% CI, 11.0至13.9)和11.8個月(95% CI, 10.1至12.8)(HR, 0.94 [95% CI, 0.78至1.14];P = 0.530)。未達到統計學意義。
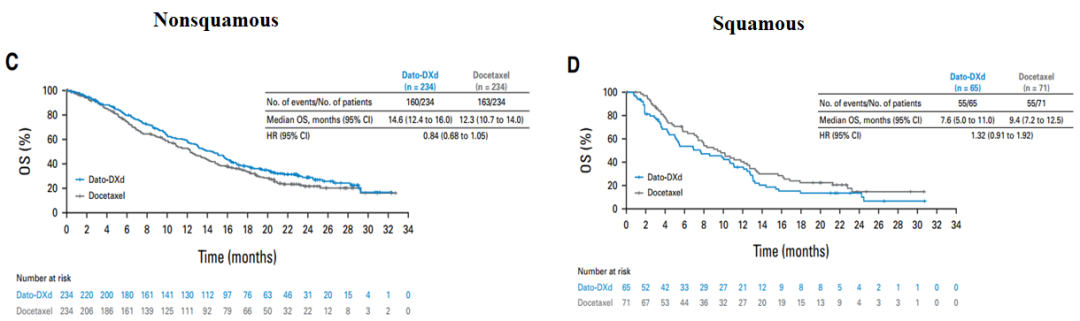
在預設的非鱗狀組織學亞組中,中位PFS分別為5.5個月對比3.6個月(HR, 0.63 [95% CI, 0.51至0.79]),中位OS分別為14.6個月對比12.3個月(HR, 0.84 [95% CI, 0.68至1.05])。在鱗狀組織學亞組中,中位PFS分別為2.8個月對比3.9個月(HR, 1.41 [95% CI, 0.95至2.08]),中位OS分別為7.6個月對比9.4個月(HR, 1.32 [95% CI, 0.91至1.92])。
(轉自:抗體圈)