1 月 17 日消息,當你讀到這行字時,體內各色各樣的細胞正在兢兢業業地工作着:視網膜細胞將捕捉到的光線轉為神經信號,大腦細胞接收信號後進行處理與理解,肌肉細胞讓眼球轉動、手部操作手機等動作成為可能,心臟細胞、紅細胞等則負責保持你的營養與氧氣供給……
為什麼細胞們能夠各司其職,不會發生混亂或者「越權」?這一切都得益於一類「指揮官」:非編碼小 RNA,簡稱小 RNA。它包括 miRNA、siRNA、piRNA。前兩種小 RNA 相關的科學發現已摘得了諾貝爾獎,申恩志團隊的最新成果,則與人類最晚發現、相較最為陌生的第三種 piRNA 有關。

北京時間今日凌晨,西湖大學生命科學學院、西湖實驗室申恩志團隊聯合吳建平團隊成功揭示了小鼠體內 PIWI 蛋白(MILI 蛋白)與 piRNA 協作切割目標 RNA(核糖核酸)的全過程。相關研究成果已於北京時間 1 月 15 日 24 時在線發表於《自然》。
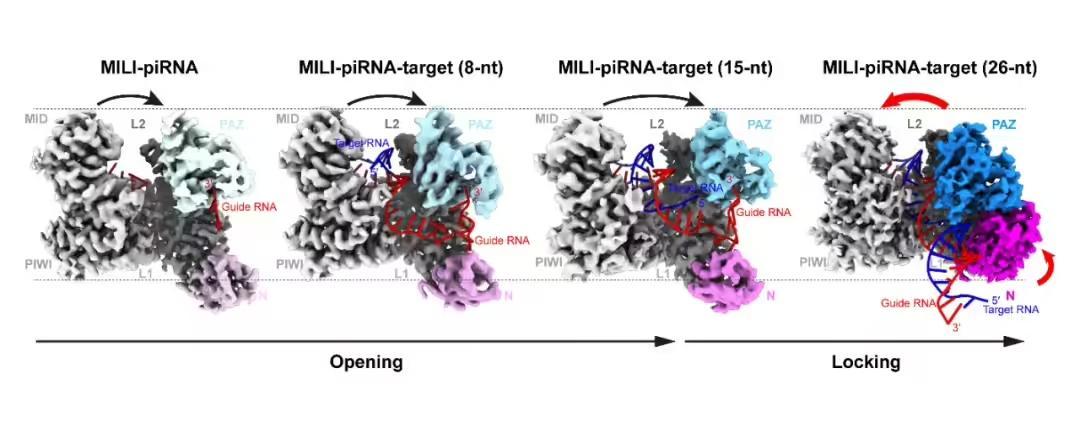
▲ piRNA 結合靶向 RNA 分子的動態變化過程
人類於 2006 年發現了 piRNA;然而直到 9 年後,申恩志開始博後工作時,這類小 RNA 身上依然充滿着未解之謎。
piRNA 在動物生殖細胞(精子與卵子)發育和生成過程中發揮重要作用。它像個保家衛國的「戰士」——piRNA 的重要功用之一,是充當「RNA 之剪」,專門在「有害」的 RNA 上來「一刀」,讓它無法再發揮功用。要了解這把「剪刀」,涉及到兩個新角色:轉座子和 PIWI 蛋白。
在人類基因組測序完成後,人們驚訝地發現,序列中參與到編碼蛋白的 DNA 僅佔 2%,其餘區域都不參與編碼。更驚奇的是,其中有一類特殊的 DNA 序列,具有在基因組內自主複製和移動的能力,可能「跳」到同一個染色體的不同位置,也可能「跳」到不同的染色體上。這種會「跳躍」的序列,即轉座子,它在 DNA 中的佔比達到了 50%。
具體來講,有兩種轉座子。一種是「剪切-黏貼」的 DNA 轉座子 —— 從原有位置直接剪切下來插入到新的位置。另一種是「複製-黏貼」的逆轉錄轉座子 —— 原有位置的轉座子 DNA 轉錄為 RNA,再逆轉錄成新拷貝的 DNA 插入到基因組的新位置 —— 這種轉座子更為常見,在整個基因組中佔到了 40% 以上。
總之,轉座子在混沌的基因池裏不斷地遊蕩,帶着屬於自己的一段序列跳躍定居。這種隨意的「跳躍」與插入,會給基因組造成不穩定、導致疾病,因而轉座子一度被稱作「垃圾基因」。儘管科學家們已發現,這些由轉座子產生的新突變,從更長的時間軸來看,對物種進化可能是有積極意義的,但這不改變大面上它依然是有害的。
piRNA 的刀鋒,正瞄準逆轉錄轉座子的 RNA。這類轉座子需要歷經「DNA-RNA-DNA」的過程才能在新位置定居,而 piRNA 能在它尚處於 RNA 階段時候,就識別出對方,「砍」斷 RNA,使得後續的轉錄和插入化為泡影;換句話說,piRNA 就像個保家衛國的「衛士」,也像一種免疫系統,能夠精準識別有害的轉座子,將對方「滅活」,從而保衛生殖細胞。
不過,僅僅是 piRNA,是無法完成這場戰鬥的。事實上,所有非編碼小 RNA 都需要一位「幫手」與之結合,來完成工作。對於 piRNA 而言,它,就是隸屬 Argonaute 蛋白的 PIWI 蛋白。
piRNA 與 PIWI 蛋白結合後,成為一個複合物,會與特定的 RNA 結合,發生「剪刀」式的切割。PIWI 蛋白就是那把具體的剪刀,可以根據 piRNA 的「指示」,在特定的 RNA(即我們所稱的靶標 RNA)的中間來一刀。