新年伊始,醫藥行業捷報頻傳。作為國內首批從biotech成功轉型為更具規模化和市場競爭力的biopharma企業,復宏漢霖在國際化進程中再傳佳音。
根據公司公告顯示,2月2日,復宏漢霖自主研發的自主研發的帕妥珠單抗生物類似藥HLX11美國上市許可申請獲美國食品藥品監督管理局(FDA)受理。這是復宏漢霖第3款在美國申報上市的自研產品。
2月5日,復宏漢霖自主研發的抗PD-1單抗H藥——漢斯狀®(斯魯利單抗,歐洲商品名:Hetronifly®)正式獲得歐盟委員會(European Commission, EC)批准,聯合卡鉑和依託泊苷用於廣泛期小細胞肺癌(ES-SCLC)成人患者的一線治療,成為全球首個且唯一在歐盟獲批用於廣泛期小細胞肺癌治療的抗PD-1單抗。
2月6日,復宏漢霖發布公告,公司與印度製藥巨頭瑞迪博士實驗室達成在研生物類似藥HLX15歐美市場授權。據悉,該產品在2024年宣佈完成臨牀I期試驗,目前,HLX15的療效比對研究正在推進中。這項授權交易將為復宏漢霖帶來超過3300萬美元首付款,交易總金額超過1.3億美元。
開年一連發布三條歐美市場進展,海外佈局動作頻頻。根據WIND數據顯示,復宏漢霖在新年開門紅的一系列利好推動下,股價近9個交易日累計上漲近20%,成功站上20港元大關(數據截至2月7日收盤)。這一表現不僅反映了市場對公司國際化戰略的認可,也彰顯了投資者對H藥商業化前景的信心。
從「中國創新」走向「全球價值」,復宏漢霖是如何做到的?
圖表一:復宏漢霖近期股價表現
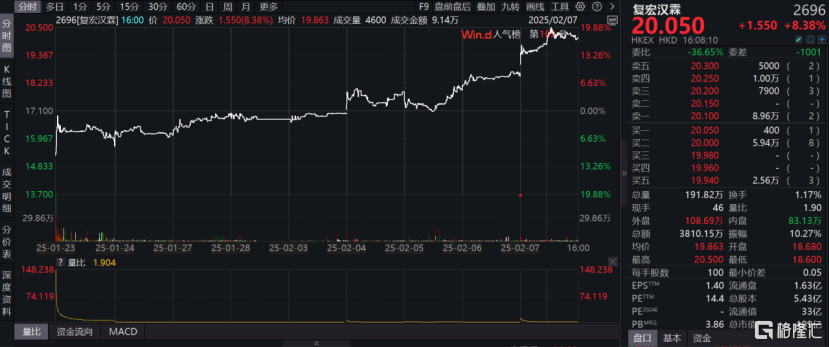
數據來源:WIND,格隆彙整理 數據截至2025年2月7日收盤
再下一城!H藥拿下歐洲上市批文
H藥在歐洲的成功獲批,無疑標誌着復宏漢霖全球化戰略征程中的一座重要里程碑。
作為全球首個且迄今唯一一款在歐洲獲得批准,用於一線治療廣泛期小細胞肺癌(ES-SCLC)的PD-1單抗,H藥憑藉其顯著的差異化優勢脫穎而出。小細胞肺癌(SCLC),尤其是其廣泛期形式,歷來是醫療領域的一大挑戰,因長期缺乏高效的治療方案而令患者深感絕望。H藥的獲批上市,猶如一束光芒,為這一重病患者羣體照亮了新的希望之路。
從市場潛力的角度審視,H藥的這一里程碑式成就不僅填補了歐洲市場在治療ES-SCLC領域的空白,更為復宏漢霖在全球範圍內的商業化佈局注入了強勁動力,為其未來的成長開闢了廣闊的空間。
根據IQVIA的數據預測,至2030年,歐洲的PD-(L)1市場規模有望突破280億美元大關。SCLC患者的佔肺癌總數的15%-20%,具有惡性程度高、轉移早、疾病進展迅速等特點,預後極差。作為首個也是唯一在歐盟獲批用於治療ES-SCLC的PD-1單抗,H藥的上市無疑將迅速搶佔市場份額,有望成長為復宏漢霖海外收入的重要支柱之一。
值得一提的是,2022年12月,H藥治療SCLC獲得EC授予的孤兒藥資格認定,有助於H藥用於治療SCLC在歐盟研發、註冊及商業化等方面享受一定的政策支持。歐盟《孤兒藥法規》確立了孤兒藥資格認定的集中審批程序,並為孤兒藥的研發和上市制定了激勵措施,包括上市後享有10年市場獨佔權。
H藥在歐洲的獲批,僅是復宏漢霖全球化戰略宏偉藍圖中的一個精彩片段。
迄今為止,H藥已在中國、印度尼西亞、柬埔寨、泰國等超過30個國家成功獲批上市。此外,復宏漢霖還通過對外授權的方式,將H藥的商業化權益擴展至美國、歐洲、東南亞、中東和北非等70多個國家和地區,構建了一個覆蓋廣泛的全球化網絡。
這一全球化的戰略佈局,不僅彰顯了復宏漢霖在國際市場上的強大競爭力,更為其未來的持續穩健增長奠定了堅實的基礎。
復宏漢霖的「野望」:邁向出海全球化2.0時代
近期一系列的出海動作,深刻揭示了復宏漢霖全球化戰略已邁入一個嶄新的「深度全球化」2.0時代,標誌着其在國際醫藥舞台上的影響力顯著提升。
近年來,隨着創新藥企的蓬勃發展,國際化已成為推動行業前行的關鍵力量。在這一背景下,復宏漢霖憑藉前瞻性的視野和創新的策略,通過License out(對外授權)、成立合資公司(NewCo)等多種方式,積極尋求全球市場的嶄新機遇,已然成為引領中國藥企國際化的先鋒力量。
除了探索更加多元、高效的出海模式,復宏漢霖的國際化征程最亮眼的莫過於成功將產品足跡拓展至全球50多個國家和地區,全面覆蓋亞洲、歐洲、美洲和大洋洲,展現出強大的全球佈局能力。
漢利康®、漢曲優®、漢斯狀®等多款產品的海外市場拓展,不僅創造了多個「首個」或「最多」的行業紀錄,更彰顯了復宏漢霖的國際化實力。曲妥珠單抗漢曲優®是首箇中、美、歐三地獲批的生物類似藥,成就了主流監管市場的「大滿貫」;H藥漢斯狀®在印尼的成功上市,標誌着其正式進軍東南亞市場,也是首個登陸東南亞的國產PD-1,同時,其在日本市場的差異化佈局以及歐盟獲批的預期,進一步鞏固了復宏漢霖在全球市場的地位;HLX14地舒單抗已提交歐美新藥上市註冊申請,HLX11帕妥珠單抗提交中美新藥註冊申請,更多國家的上市註冊申報也在加速推進,更多新產品、新適應症的全球佈局均取得突破性進展。
這些成功案例不僅驗證了復宏漢霖的國際化能力,更為其構築了堅實的競爭壁壘。
首先,從全球產能與供應鏈角度來看,復宏漢霖實現了從「中國製造」到「全球交付」。
基於10餘年的出海經驗,復宏漢霖已構建了全球化的臨牀、藥政註冊和生產的全方位能力。公司建立了徐匯基地、松江基地(一)及松江基地(二)三大生產基地,現有商業化總產能高達48,000升,實現全球產品常態化供應,全面覆蓋中國、歐洲、拉丁美洲、中東北非、北美及東南亞等關鍵市場。同時,公司建立了一套符合國際質量標準的質量管理體系,涵蓋從項目研發到物料管理、產品生產、質量控制、產品供應鏈管理以及產品上市後跟蹤的全生命周期。此前,公司商業化生產基地及配套的質量管理體系已通過中國國家藥監局、歐洲藥品管理局(EMA)、美國食藥監局(FDA)、歐盟質量受權人(QP)以及國際商業合作伙伴的實地核查及審計,榮獲中國、歐盟和美國GMP認證。
H藥在歐盟的獲批,不僅是對其臨牀數據和生產質量體系的國際認可,更為復宏漢霖後續管線(如HLX22、HLX43等)的國際化進程鋪平了道路,打開了市場對其創新藥「出海溢價」的無限遐想。
其次,復宏漢霖攜手具有本地強大商業化網絡和資源的海外商業化合作伙伴,加速滲透當地市場,並考慮自建海外商業化團隊。
在海外商業化方面,復宏漢霖攜手Abbot、Abbott、Accord、Dr. Reddy's、Eurofarma、Kalbe、Organon等跨國藥企或當地龍頭,高速推進產品在全球市場獲批落地,憑藉復宏漢霖強大的產品研發及供應能力,以及合作伙伴在當地市場的資源,高效滲透主流監管市場及新興市場國家,夯實了對終端市場的掌控力。旗下產品已在北美洲、歐洲、拉丁美洲、東南亞、中東北非等區域實現上市銷售。
據悉,公司目前也在探索自建海外商業化團隊和更加靈活高效的出海模式。
最後,復宏漢霖的創新平台也在加速全球化進程。
公司正在加速開發更多創新產品及潛在first-in-class適應症。同時,通過「國際多中心臨牀試驗」加速管線國際化,如H藥針對轉移性結直腸癌(mCRC)的III期階段臨牀已在日本、印尼等國家同步開展,有望成為全球首個針對不分型mCRC患者的一線免疫療法。HLX22聯合曲妥珠單抗的HER2雙靶向療法的國際多中心III期臨牀也已完成首例患者入組,有望成為同類療法中首個用於治療HER2+胃癌的方案。這種「差異化適應症+國際多中心臨牀協同」的模式,將顯著提升產品競爭格局,縮短創新藥在全球市場的上市周期。
小結
2月以來,HLX11(帕妥珠單抗生物類似藥)在美國獲受理、H藥在歐洲的獲批、HLX15(達雷妥尤單抗生物類似藥)超1.31億美元授權歐美市場,一系列出海闊步,不僅再次印證了復宏漢霖「生物類似藥+生物創新藥」雙輪驅動發展的戰略清醒,更是中國生物藥企出海深化的生動寫照。
通過「自主研發+全球合作+自主掌控」的三重驅動,復宏漢霖正逐步改寫中國藥企國際化的敘事篇章,從單純的產品出口轉向技術、產能、品牌的系統性輸出。
展望未來,隨着海外商業化團隊的落地、更多研發管線的推進,復宏漢霖有望成為少數真正具備全球競爭力的中國藥企,為投資者帶來見證「中國生物藥」向「全球價值」跨越的歷史性機遇。