原文作者:Carissa Wong
科學家們正在致力於使用新型分子、改造免疫細胞和基因療法來殺死衰老細胞,治療年齡相關的疾病。
插圖:Paweł Jońca
如同「殭屍」、名為衰老細胞(senescent cell)的東西潛伏在人的身體各處,從肝臟到大腦。它們不再像以前那樣正常分裂或執行功能,但也拒絕死去,並釋放出有害的生物信號,進而削弱認知能力、增加機體虛弱感,以及破壞免疫系統。最糟糕的是,它們的數量會隨着衰老而增加。
十多年來,研究人員一直在嘗試通過各種藥物來選擇性摧毀這些細胞。在2015年發表的一項關鍵性試驗中[1],妙佑醫療和斯克里普斯研究所的一個研究小組發現,兩種化合物的組合——達沙替尼和槲皮素,能夠殺死老年小鼠體內的衰老細胞。這種治療使小鼠的虛弱程度降低,心臟活力恢復,以及跑步耐力提升。這一發現為醫學界開闢了一個全新的領域,即衰老細胞選擇性清除藥物(senolytics)。
如今,來自動物研究和人類臨牀試驗的最新成果為這一領域增添了新動力。研究人員正在小鼠和猴子身上使用遺傳工具來重新編程並殺死衰老細胞。其他人則正在對senolytic免疫細胞進行改造。目前約有20項臨牀試驗正在進行中。有研究人員在測試具有senolytic特性的新藥和老藥新用藥物,希望以此對抗與年齡相關的疾病,包括阿爾茨海默病、肺病和慢性腎病。
「我堅信senolytics將在臨牀上產生重大影響。」正在研發senolytics的一家公司Unity Biotechnology的首席執行官Anirvan Ghosh說。「我認為問題只在於製劑會是什麼樣,以及第一個獲批的藥物是什麼。」
「殭屍」細胞
1961年,美國生物學家Leonard Hayflick和Paul Moorhead首次描述了衰老細胞。他們發現,實驗室培養皿中的人類細胞在達到細胞分裂的極限或約50次分裂時,將停止分裂並進入衰老狀態[2]。在實驗室中,分裂細胞可能需要數周時間纔會衰老。但研究人員尚未發現這一過程在人體內需要多長時間,衰老細胞會持續多久,以及是否所有類型的細胞都會衰老。
除了細胞分裂次數達到極限外,物理損傷、營養不良或紫外線引起的DNA損傷等因素也會導致細胞衰老。研究人員最初認為,發生細胞衰老是為了防止受損細胞無限制地複製並引發癌症。在某種程度上可能的確如此,但如果細胞不是單純地死掉,像可控的凋亡程序(apoptosis)那樣,而是死後仍然賴在體內不走,這就說不通了。
研究人員後面發現,衰老細胞之所以逃避凋亡,是為了執行一項任務,即釋放出強大的炎症信號——包括細胞因子白細胞介素-6和干擾素-γ——從而促使免疫系統清除受損細胞,這有助於為受損組織的再生和修復騰出空間。
這套流程一般運行良好,直到免疫功能隨着年齡增長逐漸減弱,導致衰老細胞過度堆積,引發過度炎症反應。研究人員發現,衰老細胞的積累和與年齡相關的炎症與許多疾病有關,包括骨質疏鬆症、糖尿病、心臟病、腎病和阿爾茨海默病等。對於該領域的許多科學家來說,這一認識促使他們不再去了解衰老細胞在做什麼,而是去研究如何消滅他們。
平衡之道
senolytics的一個關鍵策略是設計藥物,阻止衰老細胞抵抗凋亡。通常,細胞通過產生抗凋亡蛋白來存活。用藥物阻斷這些蛋白可以迫使細胞死亡。
研究人員說Unity Biotechnology公司在這一領域處於前沿。在2月進行的一項研究中[3],Ghosh和他的同事發現,糖尿病小鼠視網膜中的衰老細胞比健康小鼠更為豐富。研究小組預測,眼睛血管中的衰老細胞可能在糖尿病相關的視力喪失中發揮作用。
這種被稱為糖尿病性黃斑水腫的病症是由高血糖引起的,會導致這些纖細的血管出現滲漏,尤其在老年羣體中。這種眼部疾病是全球失明的主要原因,據估計影響2700萬成年人。但標準治療對約半數的患者幫助不大,這種治療使用的是一種最初設計用於減緩血管生長的抗癌藥物。「這是一個有待解決的問題。」 Ghosh說。
研究人員設計了一種名為foselutoclax的藥物,該藥物可阻斷關鍵抗凋亡蛋白BCL-xL的作用,它們在衰老細胞中大量存在。當將這種藥物注射到糖尿病小鼠的眼睛中時,它會殺死為視網膜供血的血管中的衰老細胞,但不會殺死健康細胞。「我們看到了非常有選擇性的清除。」 Ghosh說。
這種senolytic藥物使糖尿病小鼠視網膜血管的滲漏減少了約50%。此外,與對照組相比,接受治療的小鼠在視力測試中表現更好。接下來,研究團隊將目光轉向了人類。在II期臨牀試驗中,研究人員向約30名患者單次注射了foselutoclax。11個月後,與接受安慰劑治療的患者相比,接受senolytic 治療的患者在視力表上平均可以多看到5.6個字母。
Ghosh說,僅僅過了幾周,就有一名參與者給他打電話說,治療讓她的生活輕鬆了許多。另一名參與者的色覺迅速改善。研究團隊預計將於晚些時候發表研究結果,但與此同時,Unity正在進行另一項II期試驗,以比較senolytic療法與標準療法的優劣。
研究人員表示,Unity的試驗結果很有希望。「我認為在未來五年內,我們可能會在診所中看到這種針對糖尿病性黃斑水腫的治療方法,」在妙佑醫療研究衰老的Sundeep Khosla說。
一些科學家沒有從頭開始去研發senolytics藥物,而是測試了已有的藥物。這當中包括達沙替尼(在美國被批准作為癌症療法),以及兩種市售的植物化學衍生物槲皮素和非瑟酮。後兩者作為保健補充劑出售,用於減輕炎症、促進大腦健康和降低患年齡相關疾病的風險。這些說法是基於齧齒類動物的研究,在這些研究中,這些藥物顯示出能清除衰老細胞並減輕炎症[4]。
在2019年的一項研究中[5],研究人員使用達沙替尼和槲皮素在阿爾茨海默病小鼠模型中清除衰老的腦細胞。與接受安慰劑的小鼠相比,接受senolytics治療的小鼠腦炎症減輕,記憶力改善。受這些有前景的小鼠數據鼓舞,位於維克森林大學醫學院的Miranda Orr和她的同事去年對患有早期阿爾茨海默病的患者進行了這兩種藥物組合的首例安全性臨牀試驗。
Orr的團隊給五名患者間斷服用達沙替尼和槲皮素三個月。研究人員發現,這兩種藥物是安全的,並且在腦脊液樣本中檢測到達沙替尼,這表明它可能穿過血腦屏障進入大腦。腦脊液樣本中未檢測到槲皮素,但Orr表示,她懷疑槲皮素進入了大腦並被迅速分解。該團隊目前正在進行一項更大規模的試驗,在服用安慰劑或聯合用藥9個月後,追蹤患有和未患有阿爾茨海默病的人的認知能力。研究結果將有望於2025年公布,Orr說。
Khosla表示,很快也應該會公布迄今為止最大的達沙替尼和槲皮素人體試驗的最新數據。目前,這項研究正在接受同行評審,他的團隊研究了senolytics藥物對健康女性骨骼的影響。
免疫殺手
談到殺死體內細胞,免疫系統可以大顯身手。一些研究人員已經着手使用遺傳改造過的免疫細胞(稱為嵌合抗原受體(CAR)T細胞)的方法。這些細胞可以根據其表面顯示的分子來靶向並殺死特定的細胞。CAR-T細胞療法目前已被批准用於治療各種血液腫瘤疾病。
2024年早些時候,紐約冷泉港實驗室的細胞生物學家Corina Amor和同事在老年小鼠的肝臟、脂肪組織和胰腺的衰老細胞表面發現了一種名為uPAR的蛋白質標記[6]。研究者設計定製了CART細胞靶向殺死帶有uPAR標記的衰老細胞。研究團隊將這些經過基因編輯過的細胞注入老年小鼠的血液之中,觀察到肝臟、胰腺和脂肪中衰老細胞的比例有所下降。
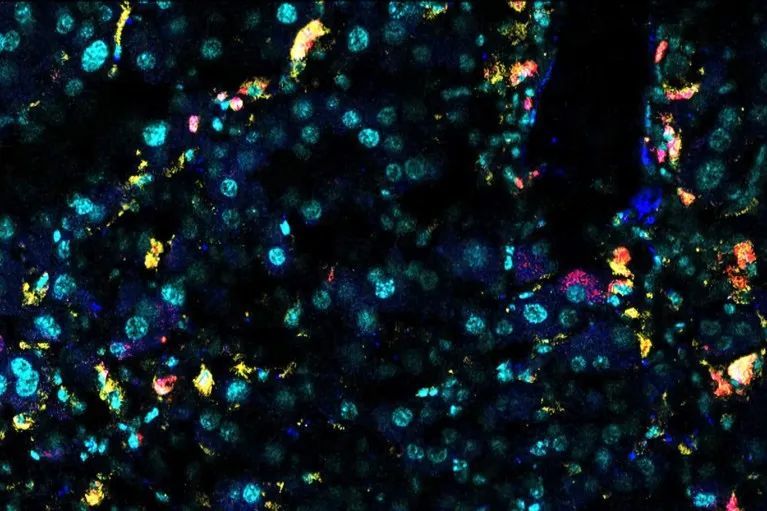
衰老的小鼠肝細胞表達β-半乳糖苷酶(白色)和uPAR(黃色)。圖片來源:紀念斯隆-凱特琳癌症中心
Amor和她的團隊發現,接受uPAR CAR T細胞治療的老年小鼠血糖水平降低,提示其代謝健康狀況改善,並且這些小鼠比接受非改造T細胞或靶向小鼠體內不存在蛋白質的T細胞治療的小鼠跑得更快更久。接受細胞清除CAR T細胞治療的小鼠均未出現T細胞毒性反應。
在年輕小鼠中,senolytic CAR T細胞可延緩與年齡相關的血糖調節能力和運動能力下降。在3月份發表的一篇預印本中[7],該團隊報告稱,senolytic CAR T細胞還使老年小鼠的腸道恢復活力。
Amor表示,還需要進一步研究以評估該療法的安全性。此外,最好為這些基於細胞的藥物配備一個開關,以防出現問題。在極少數情況下,用於治療癌症的CAR T細胞似乎會自身癌變。
Amor團隊計劃在不久的將來探索這種安全性開關。她表示,這將涉及對senolytic CAR T細胞進行改造,使其攜帶一種可通過藥物激活來誘導細胞死亡的基因。但CAR-T細胞療法成本很高,Deciduous Therapeutics的首席執行官Robin Mansukhani說。這家公司也在開發針對衰老的免疫療法。
Mansukhani寄希望於一種讓人更負擔得起的方法,即利用不同類型的免疫細胞——自然殺傷性T細胞。2021年,Deciduous Therapeutics的研究人員證明了這些細胞的抗衰老作用[8],它會隨着年齡的增長而減弱。他們還發現,能夠激活這種免疫細胞的藥物有助於消除小鼠受損肺部的衰老細胞,減少肺部瘢痕並改善存活率。
Mansukhani表示,研究人員已經開發出一系列能夠結合併激發自然殺傷性T細胞的藥物,以治療包括糖尿病和肺病在內的各種疾病。他補充道,安全性測試將在晚些時候於狗和非人靈長類動物身上進行,而臨牀試驗則在未來兩年內提上日程。他表示,這種方法依賴於較小的分子,這會比CAR-T細胞療法更容易實現。
基因治療
其他團隊則採用基因療法來殺死衰老細胞。在這種方法中,研究人員將編碼caspase-9致死性蛋白的基因封裝在脂肪膠囊中,這種膠囊鑲嵌有病毒衍生蛋白。研究發現,這些膠囊可將基因輸送到小鼠和猴子的肺、心臟、肝臟、脾臟和腎臟中的細胞。
Oisín生物技術公司首席執行官Matthew Scholz表示,健康細胞可平安無事,因為只有衰老細胞中高表達的兩種蛋白質p16和p53才能激活該基因。Scholz表示,作為進一步的安全開關,只有在給動物注射極低劑量的雷帕黴素後,這種致死蛋白纔會啓動細胞死亡。研究人員發現,在連續四個月的時間裏,每月一次的治療減輕了老年小鼠的虛弱程度,並降低癌症發生率,未造成有害副作用。Scholz說,對照組的小鼠被注射了安慰劑和低劑量的雷帕黴素。
但這種方法有個重要的侷限是,它僅依賴於一兩種蛋白質。儘管p16被廣泛用作衰老的標記物,但要準確識別這種狀態下的細胞需要多個標記物。這意味着,僅針對p16和p53的基因療法可能會消除一些具有這些標記物的健康、非衰老細胞,同時未能殺死一些缺乏這兩個標記物的衰老細胞。
找尋更好的標誌物
事實上,所有抗衰老療法都有個共同的專屬問題,因為衰老細胞不止一種類型。研究人員對於理解衰老細胞有多少種,以及它們攜帶什麼標記物纔剛開始。「如果沒有真正高效可靠的衰老細胞生物標誌物,就很難找到正確的靶點。」Orr說。
Orr是「細胞衰老網絡計劃(SenNet)」大型合作項目的成員,該項目有200多名研究人員參與,旨在繪製人類和小鼠整個生命周期中衰老細胞的圖譜。她的團隊正在使用機器學習來改進腦細胞衰老標記物的定義,然後利用這些定義來繪製衰老細胞隨年齡增長和癡呆症過程中發生的變化。
她說,最終,更好的衰老細胞標誌物將帶來更好的senolytics藥物,直到有朝一日可能預防或治療與年齡相關的疾病。在殺死殭屍細胞的問題上,Ghosh也持同樣的樂觀態度,「我認為基礎科學是如此有說服力,靶向衰老細胞肯定會有所成果。」
參考文獻:
1. Zhu, Y. et al. Aging Cell 14, 644–658 (2015).
2. Hayflick, L. & Moorhead, P. S. Exp. Cell Res. 25, 585–621 (1961).
3. Crespo-Garcia, S. et al. Nature Med. 30, 443–454 (2024).
4. Yousefzadeh, M. J. et al. EBioMedicine 36, 18–28 (2018).
5. Zhang, P. et al. Nature Neurosci. 22, 719–728 (2019).
6. Amor, C. et al. Nature Aging 4, 336–349 (2024).
7. Eskiocak, O. et al. Preprint at bioRxiv https://doi.org/10.1101/2024.03.19.585779 (2024).
8. Arora, S. et al. Med 2, 938–950 (2021).
原文以How to kill the ‘zombie’ cells that make you age標題發表在2024年5月15日《自然》的新聞特寫版塊上
© nature