2月27日,映恩生物再度遞表港交所,Morgan Stanley、Jefferies、CITIC Securities為其聯席保薦人。此前,映恩生物曾於2024年8月26日遞表港交所,於2月26日失效。
值得關注的是,今年開年,映恩生物就迎來利好,再一次實現ADC出海。1月8日,映恩生物以5000萬美元首付款,最高11.5億美元里程碑款的價格,將EGFR/HER3雙抗ADC DB-1418授權給Avenzo Therapeutics。
此次映恩生物能否再添喜事,獲得港股「通行證」呢?
手握12款ADC藥物ADC出海提速
招股書顯示,映恩生物成立於2019年,是抗體偶聯藥物(「ADC」)領域的全球領跑者,致力於為癌症和自身免疫性疾病等患者研發新一代ADC創新藥物。公司利用自身的ADC技術平台,已建立起各種具有差異化的管線,公司正在推進這些管線,目標是革新癌症治療模式,並提供可顯著改善全球患者治療效果的療法。
目前,公司擁有自主研發的兩款核心產品,即DB-1303/BNT323(一款靶向HER2癌症(包括子宮內膜癌及乳腺癌)的HER2 ADC候選藥物)及DB-1311/BNT324(一款靶向B7-H3癌症(包括小細胞肺癌、去勢抵抗性前列腺癌及食管鱗狀細胞癌)的B7-H3 ADC候選藥物)。
除核心產品外,公司還自主研發了:五款其他臨牀階段ADC,在廣泛適應症中具有潛力,根據Frost & Sullivan,就總體或主要適應症的開發進展而言,每款均躋身全球臨牀最領先之列;兩款新一代雙特異性ADC預計將於2025年至2026年進入臨牀階段;及多款其他臨牀前ADC。

截至2月19日,公司有五項處於臨牀階段的資產已獲得美國食品藥品管理局(「FDA」)及中國國家藥品監督管理局(「中國藥監局」)的研究用新藥批准。公司在17個國家的230多個臨牀試驗中心擁有七項全球多區域臨牀試驗,已有2000多名患者(超過50%位於美國、歐盟及澳大利亞)入組。公司的創新ADC資產已吸引全球領先的生物製藥公司,迄今為止已建立數個全球合作伙伴關係,包括與BioNTech SE、百濟神州有限公司、Adcendo ApS 、GSK plc及Avenzo Therapeutics, Inc.的合作,交易總價值逾60億美元(其中截至最後實際可行日期已收到約400百萬美元)。
儘管手握12款ADC藥物,但映恩生物沒有商業化產品上市,收入主要就是靠對外授權。映恩生物披露,目前就其ADC相關資產建立的合作,交易里程碑總價值已超40億美元,但公司仍未走出虧損泥淖。
2022年至2024年截至9月30日止九個月(以下簡稱:報告期內),映恩生物的收入分別約為160萬元(單位:人民幣,下同)、17.87億元、14.62億元;期內虧損分別約為3.87億元、3.58億元、5.66億元人民幣,累計虧損13.11億元。
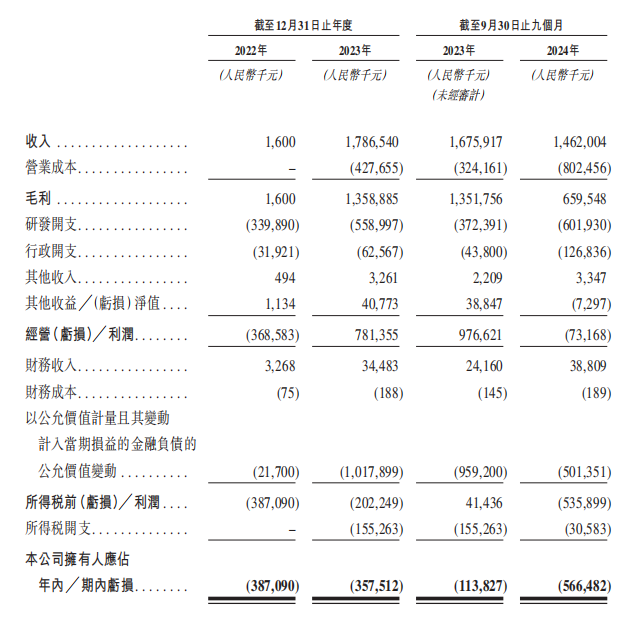
簡言之,與大多數biotech一樣,映恩生物同樣面臨資金緊張的局面。即使在實現大額授權的2023年,映恩生物仍舊虧損3.58億元。目前映恩生物資產總值18.05億元、負債總值則高達33.03億元。
商業化方面,截至2月19日,公司尚未獲得任何候選藥物的上市批准,亦未從產品銷售中獲得任何收入。預計後期ADC將在未來幾年實現商業化,公司計劃通過選擇最佳商業模式(包括建立內部商業化能力)及或與第三方(如分銷商、合同銷售組織及許可合作伙伴)合作)使候選藥物的商業價值最大化。
根據智通財經APP觀察,映恩生物持續虧損的原因,一方面在於公司需要大額研發,另一方面則是因為前期孖展造成的。IPO前的各輪孖展大額投資者多以優先股購入,隨着估值增長,映恩生物在2023年錄得大額優先股價值變動虧損10.18億元。
儘管沒有商業化產品,但是ADC出海提速為映恩生物積極「補血」。
就在今年開年,映恩生物連續完成了兩筆ADC藥物交易。一是將核心產品HER2 ADC藥物DB-1303多個適應症在中國內地、香港和澳門的商業化權益授權給瀋陽三生;另一筆交易則是將一款臨牀前管線DB-1418/AVZO-1418的全球範圍內(大中華區除外)開發、製造和商業化權益授權給Avenzo Therapeutics,Inc.兩筆交易下來,映恩生物將獲得7500萬美元的首付款,在未來實現開發、註冊及商業化的節點還可獲得里程碑付款。
Biotech授權出海浪潮席捲仍需關注商業化進程
ADC藥物海外交易日趨火熱。據市場不完全統計,2024年全年至少有14款ADC藥物達成海外交易,其中近一半藥物的交易總金額超過10億美元。
而在Biotech授權出海浪潮下,不乏佼佼者。
比如,2023年底,百利天恒與百時美施貴寶(BMS)就BL-B01D1達成潛在84億美元的重磅交易,打破了國產創新藥出海授權紀錄。
值得一提的是,百利天恒的BL-B01D1也是一款可靶向EGFR和HER3的雙抗ADC藥物,相比映恩生物的DB-1418研發進度更快,正在中國和美國進行超過20項針對多種腫瘤類型的臨牀試驗,擁有的5項適應症被納入突破性治療品種名單。
這種情況下,映恩生物顯然面臨不小的競爭壓力。
另外,以映恩生物的管線佈局來看,其既有已經過驗證的成熟靶點HER2、TROP2,也有新興靶點B7-H3、HER3等,此後還佈局了雙抗ADC(如DB-1419),及針對自免疾病的ADC(如DB-2304)。
在進度和差異化開發策略上,以靶向HER2的DB-1303為例,其首個適應證為HER2表達EC,避開了與已上市藥物撞車,目前正處於全球單臂2期註冊研究階段,最早將於2025年向FDA(美國食藥監局)申報加速批准。就HER2 ADC全球市場容量來看,預計該市場自2023年至2028年及自2028年至2032年將分別按30.8%及16.8%的年複合增長率增長,並於2032年達到345億美元。
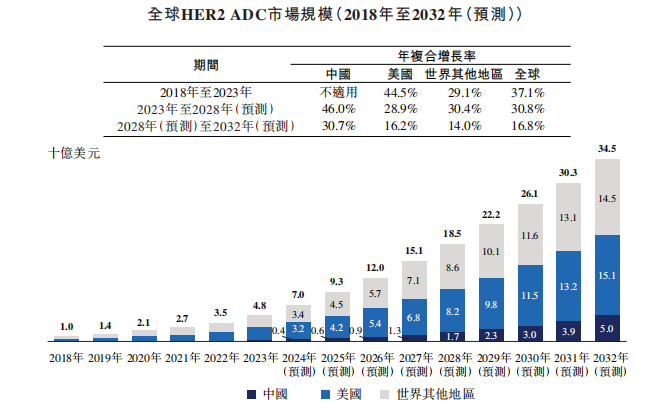
就競爭格局來看,截至最後實際可行日期,在美國有兩款HER2 ADC(即Enhertu®及Kadcyla®)獲批,而在中國則另有一款HER2 ADC(即愛地希®)獲批。截至同日,有三款HER2 ADC(包括Enhertu®)正處於全球多區域臨牀試驗(MRCT)階段的III期臨牀開發或更後的階段。諸多競爭對手林立,可見映恩生物的市場化進程並不算早。
綜上,由於映恩生物的產品尚未商業化,研發投入加上前期孖展帶來的優先股價值變動,公司難掩虧損。但是ADC出海為公司帶來入賬,一定程度上緩解其流動性壓力。其而從招股書來看,公司多數管線產品均處於臨牀早期,因此在競爭激烈的ADC技術平台能否脫穎而出,依然要看其後續研發實力和市場表現。