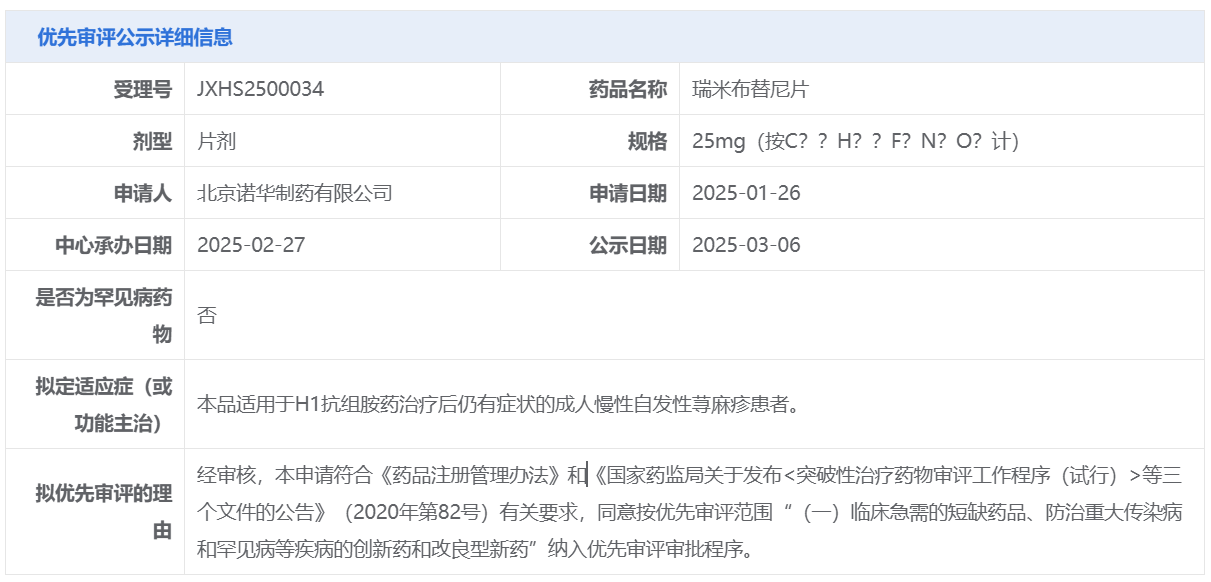
智通財經APP獲悉,3月6日,中國國家藥監局藥品審評中心(CDE)官網公示,諾華(NVS.US)申報的1類新藥瑞米布替尼片的上市申請擬納入優先審評,適用於H1抗組胺藥治療後仍有症狀的成人慢性自發性蕁麻疹(CSU)患者。這項上市申請此前已於今年2月27日獲得CDE受理。
公開資料顯示,瑞米布替尼(remibrutinib)是諾華在研的BTK抑制劑,該產品的首發適應症為治療慢性自發性蕁麻疹,針對該適應症的3期臨牀研究已經取得積極結果,患者最早在接受瑞米布替尼治療一周後其CSU症狀便獲得改善,並持續至52周。值得一提的是,這是瑞米布替尼在全球範圍內首次申報上市。
CSU是指持續6周或更長時間的慢性蕁麻疹,導致該疾病的根本原因是內在因素而非暴露於過敏原或外部誘因,其特徵是突然出現瘙癢性風團和/或深部組織腫脹 (血管性水腫,可發生在面部、喉部、手和足) 。
Remibrutinib是一種在研的高選擇性共價結合口服BTK抑制劑,可阻斷BTK級聯反應並抑制導致瘙癢性風團和腫脹的組胺釋放。當remiburutinib與標準劑量的抗組胺藥聯合使用時,會針對炎症通路的兩個部分,產生「雙管齊下」的效果,針對炎症通路的兩個部分,remiburutinib抑制組胺釋放,抗組胺藥抑制組胺受體,由此減輕CSU症狀。