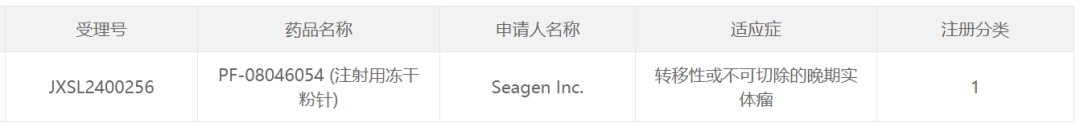
智通財經APP獲悉,3月10日,中國國家藥監局藥品審評中心(CDE)官網最新公示,輝瑞(PFE.US)公司旗下Seagen申報的1類新藥PF-08046054(注射用凍乾粉針)獲得臨牀試驗默示許可,擬開發治療轉移性或不可切除的晚期實體瘤。公開資料顯示,這是輝瑞在研的一款潛在「first-in-class」PD-L1靶向抗體偶聯藥物(ADC)。
截圖來源:CDE官網
根據輝瑞公開資料介紹,PF-08046054(又稱SGN-PDL1V、PDL1V)是一款靶向PD-L1的ADC,由抗PD-L1抗體、連接子和微管破壞劑MMAE(monomethyl auristatin E)組成,可通過直接細胞毒性、旁觀者殺傷、免疫原性細胞死亡來發揮抗腫瘤活性。在臨牀前研究中,這款ADC產品在PD-L1低表達或表達異質性高的動物模型中也展現出抗癌活性。
在2024年歐洲腫瘤內科學會(ESMO)大會上,研究人員公布了PF-08046054的1期臨牀中期結果(SGNPDL1V-001研究)。
截至2024年3月6日,55名患者接受了治療,中位年齡為60歲(範圍24-72歲)。未見劑量限制性毒性(DLT);1.75 mg/kg為評價的最高劑量。最常見的治療相關不良事件(TRAEs)為周圍感覺神經病變、乏力、疲勞和噁心,大多數患者的嚴重程度為1-2級。有效性方面,研究者評估的所有劑量和腫瘤類型的客觀緩解率(ORR)為27.3%(確定的ORR為12.7%),確定應答的中位持續時間為7.9個月。從1.25 mg/kg劑量開始觀察到客觀反應,且與PD-L1表達無關。