智通財經APP獲悉,3月19日,中國國家藥監局藥品審評中心(CDE)官網最新公示,賽諾菲(SNY.US)申報的度普利尤單抗注射液一項新適應症上市申請擬納入優先審評,擬定適應症為大皰性類天皰瘡。
3月11日,再生元(REGN.US)和賽諾菲公佈了度普利尤單抗治療中重度大皰性類天皰瘡(BP)成人患者的關鍵性2/3期臨牀研究結果,該試驗達到了所有主要及關鍵次要終點,接受度普利尤單抗治療的患者獲得持久緩解的比例是安慰劑組的5倍。目前,美國FDA已經接受度普利尤單抗用於治療成人BP的上市申請,並授予其優先審評資格。
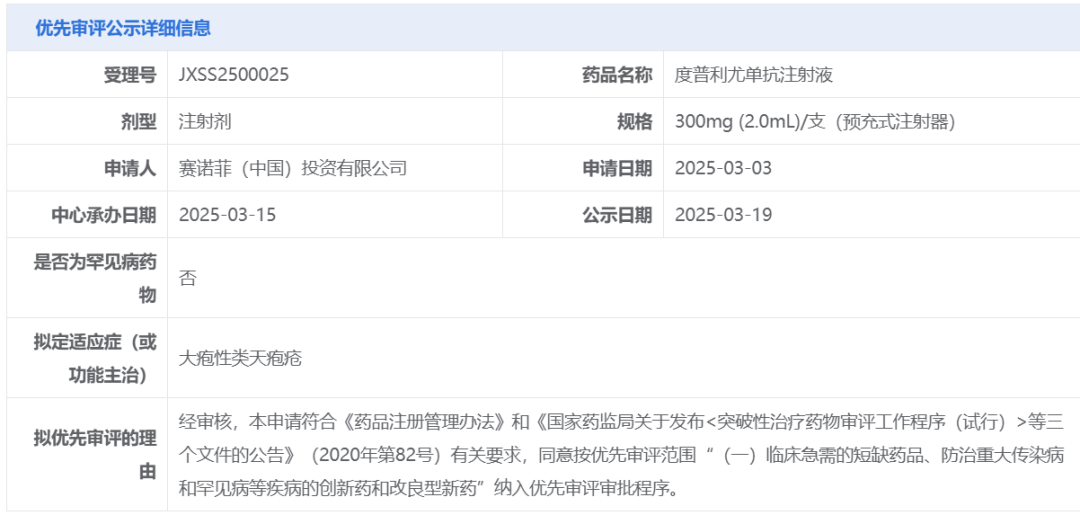
截圖來源:CDE官網
BP是一種慢性且易復發的皮膚病,伴有潛在的2型炎症,通常發生於老年人羣。其特點為劇烈瘙癢、水皰、皮膚髮紅及疼痛性病變。水皰和皮疹可能遍佈全身,導致皮膚出血和結痂,使患者更易感染,並影響日常生活。
度普利尤單抗(dupilumab)是FDA批准的首個抗IL-4Rα抗體,由賽諾菲和再生元聯合開發。它能夠通過IL-4和IL-13「雙靶點」的創新作用機制阻斷2型炎症通路,降低2型炎症的病理性反應,從機制上治療2型炎症相關疾病。研究表明,IL-4和IL-13是2型炎症的關鍵驅動因素,在多種炎症性疾病中發揮重要作用。