近期港股IPO市场显著回暖,接连迎来宜宾银行(02596.HK)、布鲁可(00325.HK)、脑动极光-B(06681.HK)、英诺赛科(02577.HK)等多只新股上市。
与此同时,还有更多企业正在涌向港股市场。近日,劲方医药科技(上海)股份有限公司(以下简称“劲方医药”)首次向港交所递交IPO文件,拟通过第18A章登陆主板市场。
这只还未盈利的生物科技股成色如何?
股东阵容豪华,已有商业化产品
劲方医药成立于2017年,专注于肿瘤、自体免疫和炎症性疾病领域的创新药物开发。虽然成立时间不算太长,但劲方医药已完成多轮投资,并获得了多方青睐。
根据招股书,劲方医药的股东阵容十分豪华,背后有深创投、石药集团(01093.HK)、泰格医药(03347.HK)、百度(09888.HK)等知名个人及机构。

而经过多年发展,截至2024年12月21日,劲方医药的产品管线包括8款候选药品,其中5款处于临床开发阶段。劲方医药有2款核心产品——GFH925和GFH312。
GFH925(fulzerasib,商品名达伯特®)是一款劲方医药自主发现的创新药物,已在中国获商业化批准,其用于治疗晚期非小细胞肺癌(NSCLC),为中国首款以及全球第三款获批的选择性Kirsten大鼠肉瘤(KRAS)G12C抑制剂。而GFH312是一款劲方医药自主研发的高效小分子抑制剂,能针对受体相互作用的丝氨酸/苏氨酸蛋白激酶1(RIPK1)并抑制其激酶活性。劲方医药已获得FDA关于在美国开展第二期临床试验的IND批准,以评估GFH312对外周动脉疾病(PAD)伴间歇性跛行(IC)患者的安全性和疗效。
除核心产品外,劲方医药旗下还有GFH375、GFH276、GFS202A等在研产品,如下图所示。

收入来源于授权,盈利难题未解
鉴于劲方医药的核心产品GFH925于2024年8月方获国家药监局批准,且已与信达生物有授权交易,因此其招股书财报中的收入来自于知识产权许可及提供研发服务。
据悉,在2021年9月,劲方医药与信达生物(01801.HK)就GFH925达成合作。信达生物获得在中国内地、香港、澳门及台湾开发及商业化GFH925的权力,同时还拥有GFH925在中国境外地区的独家选择权。
而信达生物将向劲方医药一次性支付2200万美元不可退还和不可抵扣的前期费用,并且当GFH925在大中华区达到指定里程碑时,劲方医药还有望获得高达1.32亿美元的里程碑付款。截至2024年12月21日,劲方医药已根据GFH925授权协议获得3700万美元收入。
不过,根据2024年1月11日签订的补充协议,劲方医药与信达生物同意终止GFH925授权协议项下的中国境外选择权。劲方医药拥有在中国以外地区针对任何适应症开发、生产和商业化GFH925的独家权利。
坏消息在于,劲方医药需在2026年12月1日前分期向信达生物支付合共2000万美元的不可退还终止费用。截至2024年12月21日,劲方医药已向信达生物支付200万美元。
此外,2022年劲方医药与SELLAS就GFH009及相关备用分子或中间体的开发、生产及商业化达成授权协议。根据协议,SELLAS支付首期付款1000万美元,以及在相关开发里程碑达成后最多支付4800万美元开发及监管里程碑付款,在达成特定销售净额时支付最多9200万美元销售里程碑付款。截至2024年12月21日,劲方医药收到SELLAS的全额首期付款1000万美元。
2023年,劲方医药又与Verastem达成合作,后者获得包括GFH375在内等项目的选择权。
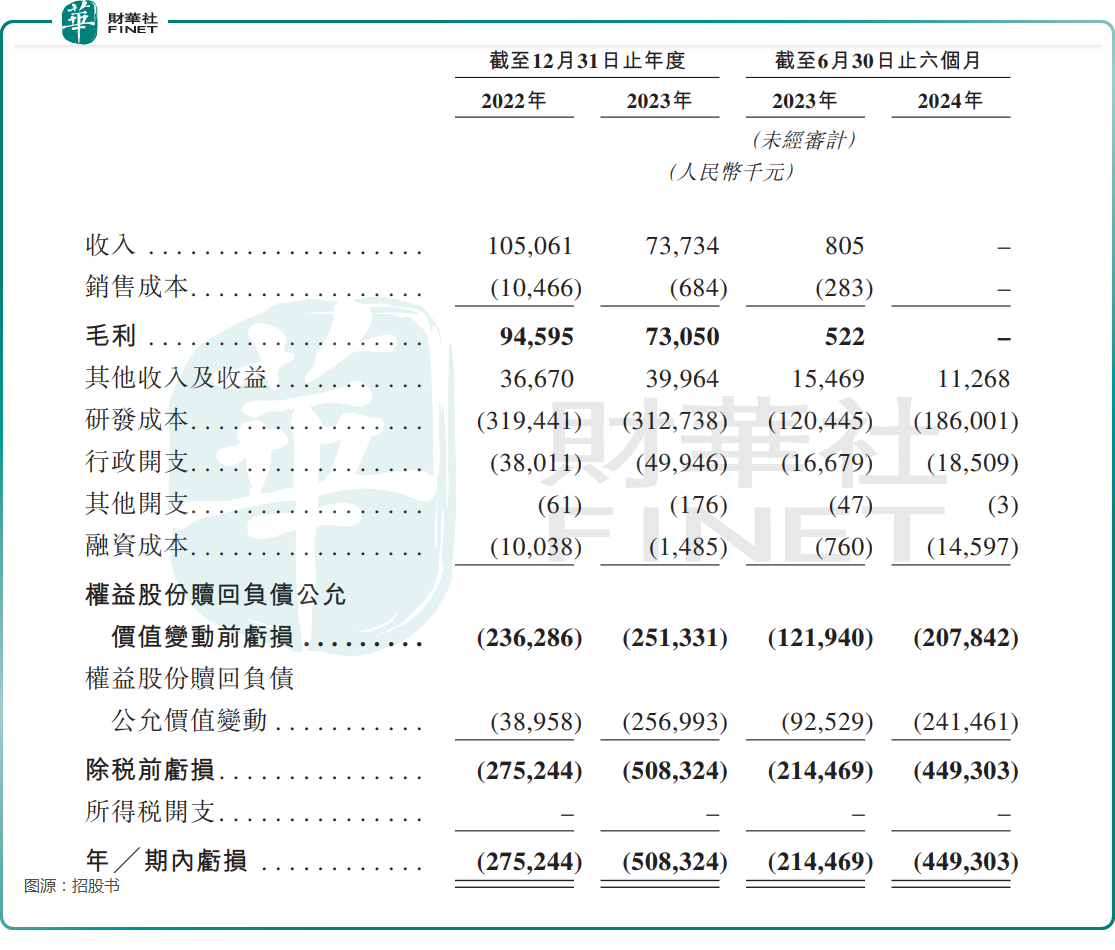
通过上述授权,2022年-2024年上半年,劲方医药分别实现收入1.05亿元(人民币,下同)、7373.4万元、0元;期内的亏损分别为2.75亿元、5.08亿元及4.49亿元。
之所以持续陷入亏损,除收入的问题外,也和研发费用、权益股份赎回负债公允价值变动前亏损有关。数据显示,2022年-2024年中期,其研发费用分别为3.19亿元、3.13亿元及1.86亿元。
一方面,劲方医药的产品频频被其他药企看中,这表明公司的研发能力出色,旗下产品的商业化潜力不错。不过,另一方面,频繁将产品的商业化权力授权给其他药企,无疑会有一点“杀鸡取卵”的嫌疑,或许并不利于企业的长远发展。
另外,靠授权收入终究不是长久之计,劲方医药显然还是比较缺乏持续的“造血”能力。
而截至2024年10月31日,劲方医药的现金及现金等价物为2.80亿元,现金流处于偏紧状态。
对于资金压力,劲方医药也表示,将继续密切监控经营现金流量,预期在需要时进行下一轮融资,并至少保留12个月的缓冲期。
商业化前景如何?
根据招股书,随着商业化KRAS G12C抑制剂药物的持续市场渗透和新药的开发,全球KRAS G12C抑制剂药物市场预计将从2023年的3.19亿美元快速增长至2032年的27.48亿美元,复合年增长率为27.0%。
竞争格局方面,劲方医药的GFH925 (fulzerasib)是中国首款获批商业化的KRAS G12C抑制剂药物。不过,截至2024年12月21日,全球还有另外三种KRAS G12C抑制剂(adagrasib、sotorasib和garsorasib)获批,还有七种在研的KRAS G12C抑制剂至少已进入III期临床试验。
而劲方医药认为,GFH925在治疗NSCLC方面优于其他两种经FDA批准的选择性KRAS G12C抑制剂药物,具有更高的安全性和更好的疗效。
劲方医药在招股书中表示,公司预期GFH925将符合2026年国家医保药品目录的谈判资格。截至2024年12月21日,GFH925的专利期限尚余超过15年,公司预期将从GFH925取得可观的商业回报,以支持未来增长。
在另一款核心产品GFH312所属领域,截至2024年12月21日,全球尚未有获批准的RIPK1抑制剂药物。但是截至2024年12月8日,全球有七种RIPK1抑制剂候选药物正在进行临床开发,而GFH312是唯一一款用于治疗PAD和PBC的候选药物。
总的来看,劲方医药的研发实力算是经受过其他药企的验证,比较有保障,但公司的自我“造血”能力亟待加强,此次能否成功上市对公司来说具有重要影响。